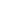研究方法
01 技术原理
DNBelab C4技术是基于负压的液滴微流控系统,通过引入自主专利的液滴标签技术(Disc-seq:Droplet-indexed high-throughput single-cell sequencing),将带有标签的捕获磁珠与单个细胞或者细胞核包裹在液滴中,采用Droplet index的技术实现磁珠的超泊松分布,在液滴中完成细胞裂解和捕获mRNA或DNA分子及用于识别来自同一液滴磁珠的标签序列,对cDNA和Droplet index进行文库构建和测序,即可一次性获得大量细胞的基因表达或染色质开放区基因信息。此技术与常规液滴单细胞测序技术如Drop-seq平台1%-3%的细胞回收率相比,回收率提高至30%-60%,显著提高了细胞的利用率,降低了单次细胞投入量。
02 技术流程
单细胞测序的一般流程包括细胞悬液制备、单细胞分离、裂解、扩增、建库、测序、数据分析等步骤。

scRNA-seq
该技术基于便携的负压装置将带有标签的mRNA捕获磁珠与单个细胞或者细胞核包裹在液滴中,采用Droplet index的技术实现磁珠的超泊松分布,在液滴中完成细胞裂解和捕获mRNA分子及用于识别来自同一液滴磁珠的标签序列,对cDNA和Droplet index进行文库构建和测序,即可一次性获得大量细胞的基因表达信息。
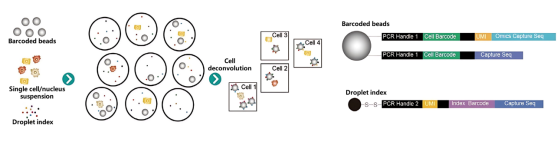
图1 基于自主标签技术(Disc-seq)的单细胞转录组测序技术 scRNA-seq
scATAC-seq
单细胞ATAC-seq从组织或细胞富集细胞核,然后利用Tn5转座酶对染色质开放区进行切割,通过DNBelab C4单细胞设备,包裹转座后的细胞核和带有标签的磁珠,在液滴内完成染色质开放区的富集和扩增,后续可根据高通量测序流程制备文库并进行测序及生信分析,转座后细胞核投入芯片5,000-15,000,获取1,500-9,000细胞,双包率 <5%。

03 建库流程
scRNA-seq
1)逆转录:将生成的液滴经过破乳后,构建逆转录反应体系完成 RNA 反转录。
2)二链合成:将反转录产物利用二链合成反应体系进行二链合成。
3)PCR扩增:对合成的cDNA按照设置PCR反应体系及参数进行PCR扩增。
4)cDNA及oligo产物纯化:将PCR产物使用Cleanup Beads A完成纯化,分别纯化出cDNA和oligo产物。
5)文库质量检测:取1μl cDNA及oligo产物使Qubit dsDNA HS Kit检测浓度,使用Agilen DNA分析试剂盒检测片段分布。
6)上机测序:文库检测合格,上机测序。
scATAC-seq
1)酶处理:将生成的液滴经过破乳后,利用ATAC Enzyme II的反应体系进行酶处理,去除冗余片段。
2)PCR扩增:对回收的DNA按照设置PCR反应体系及参数进行PCR扩增。
3)PCR扩增产物纯化:将PCR产物使用Cleanup Beads A完成纯化。
4)文库质量检测:取DNA产物使Qubit dsDNA HS Kit检测浓度,使用2100 High Sensitivity Chip检测片段分布。
5)上机测序:文库检测合格,上机测序。
04 测序策略
使用华大自主研发的国产化DNBSEQ Tx系列超高通量的测序仪进行测序。
scRNA-seq
测序读长:30+100+10bp 测序数据量:500M reads
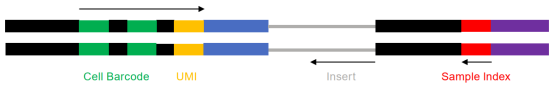
图2 scRNA 测序策略示意图
scATAC-seq
测序读长 20+50+50bp 测序数据量:500M reads

图3 scATAC测序策略示意图
05 信息分析
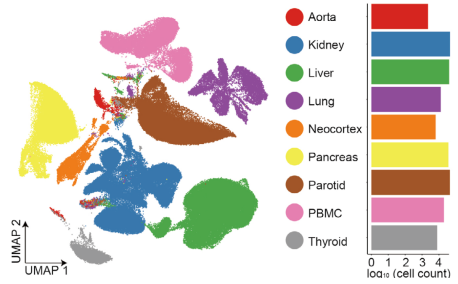
图4 食蟹猴组织/器官水平的单细胞UMAP聚类结果(左)以及通过质控的每种组织中的细胞数量(右)
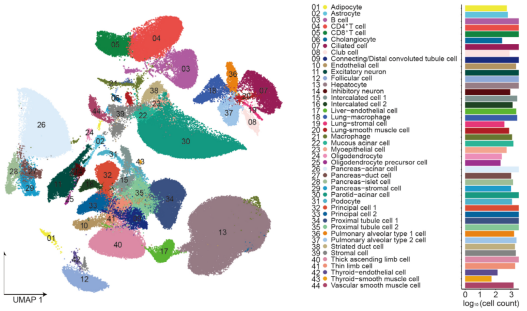
图5 食蟹猴所有 cluster 的细胞类型注释(左)以及通过质控的每种细胞类型的细胞数量(右)
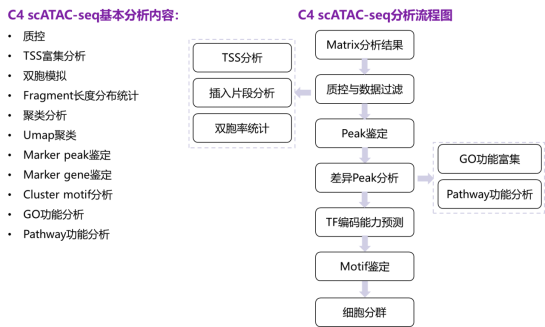
图6 C4 scATAC-seq分析流程图
C4 scATAC-seq 部分结果展示:
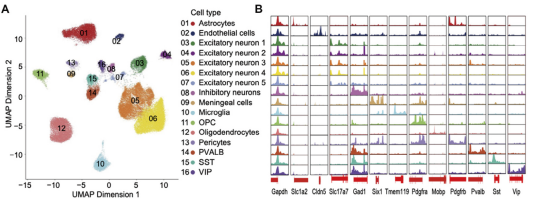
图7A大鼠大脑皮层样本scATAC-seq数据的UMAP聚类图(共计29,023个单细胞核数据);
图7B不同细胞类型中marker基因及管家基因的染色质开放区域图(如Tmem119基因的TSS区域仅在microglia中检测到,而在其他细胞类型中没有)